近年来, 欧盟市场上的 医药产品 越来越多地在欧盟以外生产。虽然这一趋势在 活性成分 的生产中尤为明显 ,但在 成品药的生产中也越来越普遍 。
与此同时, 全球化 也使 药品供应链 变得 更加复杂。为确保监督,欧盟将药品进口商归类为生产商,要求他们获得生产进口授权 (MIA),并遵守《药品生产质量管理规范》(GMP) 规定。
这一框架要求实施 药品质量体系、配备足够的人员和设施、进行投诉和召回管理以及严格的供应链控制。
在本指南中,我们将探讨 GMP 附件 21的主要方面 、其对药品进口商的影响以及确保合规的最佳做法。
GMP 附件 21:概述
GMP 附件 21 规定了 MIA 持有者 从 欧盟/欧洲经济区 以外进口医药产品 的 GMP 要求。 该附件适用于
- 人用医药产品
- 兽用医药产品
- 研究用医药产品
但是,它不包括 没有欧盟/欧洲经济区上市许可但 直接再出口的产品。
GMP 附件 21中 "进口 "的定义
该附件提供了对进口的通用解释,将其定义为 从 欧盟/欧洲经济区 以外 实际引进 医药产品 。
进口是一个受监管的过程, 只有在 欧盟/欧洲经济区国家 内 进行实际进口和 清关后,质量受权人(QP)才能进行批次放行。
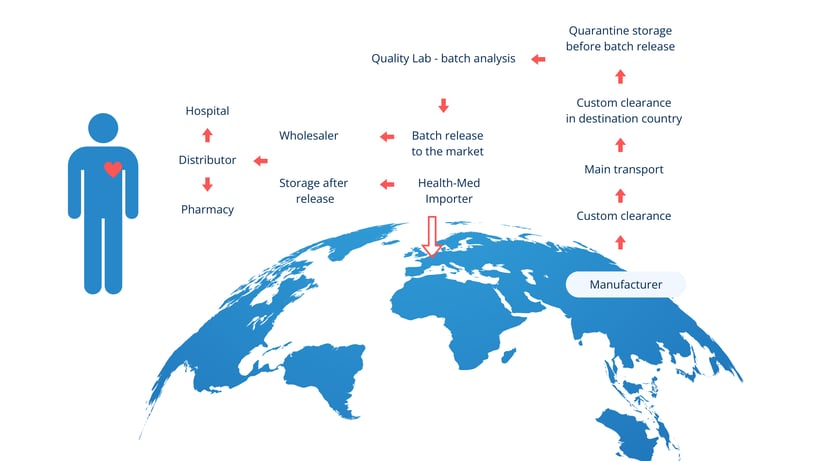
进口过程中的关键场所
GMP 附件 21 强调了涉及 医药产品进口的两个关键场所 :
- 实际进口地点 - 医药产品首次进入欧盟的地点。
- QP 认证地点 - 质量受权人 (QP) 在放行前进行批次认证的 地点 。
必须在 整个供应链的大背景下考虑这些地点 ,其中还包括
-
原料药制造商
-
第三国医药产品制造商
-
运输公司
-
进口产品的 QC 检测机构
-
营销授权持有人 (MAH)
进口商的合规要求
对于从 未签互认协议(MRA)国家进口的医药产品 , 欧盟法律规定在进口时必须进行批次检测 ,然后 根据 GMP 附件 16 进行QP 认证 和放行 。
检测地点 和 最低检测要求 概述如下:
- 2001/83/EC 号指令第 51(1)(b)条 (针对人用医药产品)
- 第 2001/82/EC 号指令第 55(1)(b)条 (兽药)
参考 Eudralex 指南
GMP 附件 21 参考了 Eudralex的其他 章节和附件,特别是 附件 16,其中已规定了 质量受权人 (QP) 在 批次认证和放行 方面 的责任 。
不过, 附件 21 进一步强调了营销授权持有人(MAH) 在确保整个进口和生产过程符合 GMP 方面的作用。
例如
- MAH 必须确保质量保证人员 在任何时候都能全面查阅批次文件。
- MAH 对医药产品的营销负有最终责任 ,必须与所有相关生产基地签订书面协议。
进口中的产品质量回顾 (PQR)
附件 21 还明确了 进口产品的 产品质量回顾 (PQR) 要求 。 认证 QP 必须
- 将 进口检测点的分析结果 与 第三国制造商的分析证书进行比较 。
- 只要质量保证员能获得稳定性数据,即使在第三国进行测试,也要确保 持续的 稳定性计划 到位。
结论
随着药品生产和供应链的不断全球化, GMP 附件 21 在确保进口医药产品的监管方面发挥着至关重要的作用。
该附件加强了 MIA 持有者的框架 ,强调了 QP 的责任、供应链的完整性和严格的质量控制。
参与向欧盟进口药品的公司必须在 合规要求方面保持领先 ,确保文件的稳健性,并 在整个供应链中建立 强有力的合作关系。
在进口药品的 GMP 合规性方面需要支持?
在 QbD 集团,我们为向欧盟进口药品的公司提供全面的服务。我们的 GMP 认证实验室和质量受权人 (QP) 服务可确保无缝 批次放行、符合法规要求和高效的进口流程。
让我们简化您的欧盟市场准入程序。 立即联系我们的专家。


