La normativa vigente exige la validación de los procesos de fabricación en la industria farmacéutica y, una vez validados, deben ser objeto de un seguimiento continuo para demostrar que se mantienen bajo control y dan lugar a un producto de calidad. Este seguimiento debe mantenerse durante todo el ciclo de vida del producto para garantizar la calidad prevista en el diseño del producto.
Debe quedar claro que la validación nunca termina realmente, las actividades simplemente cambian del diseño del proceso y la cualificación del proceso a la fase de verificación continua del proceso. ¿Ha validado ya su(s) sistema(s) informatizado(s)? Entonces las revisiones periódicas de CSV son un paso importante.
En este post, vamos a explicar
- qué es una revisión periódica CSV,
- cuál es su propósito,
- y con qué frecuencia debe realizarlas.
También hablaremos del proceso a seguir y de la documentación mínima necesaria para realizar una revisión periódica basada en riesgos de sus sistemas validados.
¿Qué es una "revisión periódica" en CSV?
Una Revisión Periódica es una evaluación de diversos elementos para determinar el estado de validación y las acciones necesarias para mantener el estado validado de los sistemas o equipos, a través de la cual demostraremos y garantizaremos que siguen siendo aptos para el uso previsto.
¿Qué entendemos por "mantenimiento del estado validado"?
Para mantener un estado validado, las empresas deben tomar todas las medidas necesarias para documentar y analizar los cambios, errores o fallos de funcionamiento de un sistema o equipo, a fin de determinar si sigue siendo adecuado para el propósito y el proceso al que sirve.
El "mantenimiento del estado validado" incluye demostrar continuamente, mediante la revisión de los datos del proceso, el control de cambios, las desviaciones, las acciones correctivas y preventivas y otras actividades relacionadas, que el proceso de fabricación sigue estando bajo control y da como resultado un producto que garantiza la calidad y la seguridad del paciente.
¿Cuál es la finalidad de las revisiones periódicas del CSV?
El objetivo de una revisión periódica es confirmar que los sistemas se mantienen en un estado validado y cumplen todas las normas y procedimientos aplicables a lo largo de su ciclo de vida operativo.
Frecuencia de las revisiones periódicas del CSV
Dependiendo del impacto GxP de su sistema, debe determinarse la frecuencia de la revisión periódica. La frecuencia mínima recomendada es de una vez al año después de que el sistema o equipo se libere para su uso productivo.
Los elementos más comunes a considerar durante una revisión periódica de CSV
Los elementos más comunes a tener en cuenta durante una revisión periódica son:
- El informe de revisión periódica anterior, así como las acciones y recomendaciones realizadas.
- Historial de cambios del sistema
- Registros de mantenimiento, registros de calibración y registros de uso del sistema.
- Documentación, que incluye procedimientos, registros de capacitación de usuarios actuales, documentos de validación y documentos del ciclo de vida del sistema.
- Matriz de usuarios del sistema actualizada, junto con la matriz de capacitación de usuarios.
- Registros de calidad, como desviaciones, CAPAS, auditorías, registros de cambios, etc.
- Pista de auditoría del sistema.
- Rendimiento del sistema.
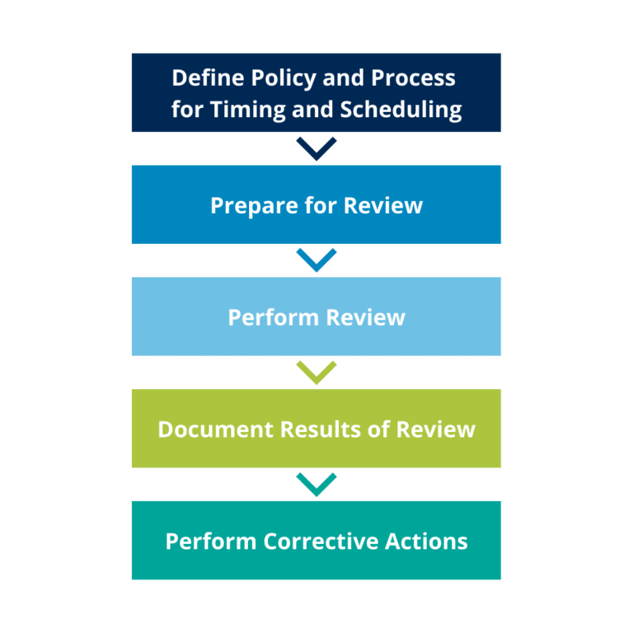
Proceso de revisión periódica del CSV
En general, el proceso que elija para llevar a cabo las Revisiones Periódicas de CSV debe estar descrito en un procedimiento operativo estándar (SOP ) con las plantillas necesarias para realizar la evaluación.
- El proceso de revisión periódica debe ser general y aplicable a todos los sistemas. Debe aplicarse a los entornos operativos y no a los entornos de desarrollo o de pruebas de soporte. La profundidad y el rigor de la revisión deben basarse en el impacto, la complejidad y la novedad del sistema o en la naturaleza de un incidente o evento que desencadene una revisión.
- Cuando proceda, el examen periódico del sistema informático puede llevarse a cabo como parte de una actividad más amplia, como el examen periódico de un proceso de producción.
- Las revisiones periódicas deben tener en cuenta y referirse a otras revisiones apropiadas, como la revisión de los registros de seguridad, y no deben duplicar actividades.
- Puede ser útil elaborar listas de verificación para los exámenes periódicos que sean específicas de sistemas concretos.
- Se debe establecer un proceso para las revisiones de tiempo y programación. Los períodos de revisión de sistemas específicos deben basarse en el impacto, la complejidad y la novedad del sistema.
- Cualquiera que sea el método elegido, el proceso debe estar documentado y aprobado por la gerencia de la empresa regulada, y los criterios de responsabilidad y decisión deben estar claramente definidos. También debe definirse claramente la responsabilidad de gestionar el proceso de planificación y programación y de asignar recursos para las revisiones.
¿Necesitas ayuda?
¿Necesitas ayuda con la preparación de tus PNT y plantillas para la Revisión Periódica de tus sistemas? ¿O prefieres que un experto te apoye en el proceso completo de revisiones periódicas de todos tus sistemas GxP? QbD Group estará encantado de ayudarte.














.jpg)





