.jpg?width=1600&height=900&name=Medical%20Writing%20for%20Medical%20Devices%20-%20Clinical%20-%20QbD%20Group%20(1).jpg)
Expertos en ensayos clínicos de dispositivos médicos
QbD Clinical es el experto europeo especializado en ensayos clínicos para dispositivos médicos. Colaboramos con empresas de todo el mundo, garantizando que cumplen con las normas más estrictas de calidad y seguridad en todas las etapas del producto. Ponemos dedicación en cada tarea que hacemos, desde una simple consulta hasta un ensayo clínico completo.
¿Cómo podemos ayudarte?
Contamos con una amplia experiencia en los retos asociados a los dispositivos médicos, con especial atención a la cardiología, vascular, neurología y ortopedia. A diferencia de las CRO que trabajan principalmente con productos farmacéuticos, nosotros nos especializamos exclusivamente en ensayos clínicos de dispositivos médicos, ofreciéndote un apoyo experto adaptado a tus necesidades.
Neurología
- Enfermedad de Alzheimer
- Parkinson
- Esclerosis múltiple
- Epilepsia
- Derrame cerebrovascular
- Otros
Ortopedia
- Osteoartritis
- Artritis reumatoide
- Trastornos de la columna vertebral
- Reparación de fracturas
- Otros

¿Por qué QbD Group?
Con más de 10 años de experiencia, QbD Clinical ofrece soluciones clínicas flexibles y personalizadas para ayudar a comercializar los productos sanitarios de forma eficaz, garantizando al mismo tiempo el cumplimiento de las normas MDR e ISO 14155.
- +52 indicaciones terapéuticas
- +250 clientes en todo el mundo
- +50 países
- +92 expertos clínicos en todo el mundo
- +200 ensayos clínicos
- +650 proyectos realizados
- +2400 centros clínicos
Siempre dispuestos a compartir nuestra experiencia
Clinical Solutions
- Desarrollo de estrategias y protocolos para la generación de pruebas clínicas.
- Selección de centros, supervisión y apoyo normativo.
- Redacción médica exhaustiva, incluidos informes de validez científica y documentación de seguimiento clínico posterior a la comercialización.
Regulatory Affairs
- Marcado CE, autorización de la FDA y estrategias de entrada en el mercado.
- Documentación técnica y paquetes de presentación para MDR y mercados mundiales.
- Servicios PRRC, representación en el país, representación legal y apoyo normativo posterior a la comercialización.
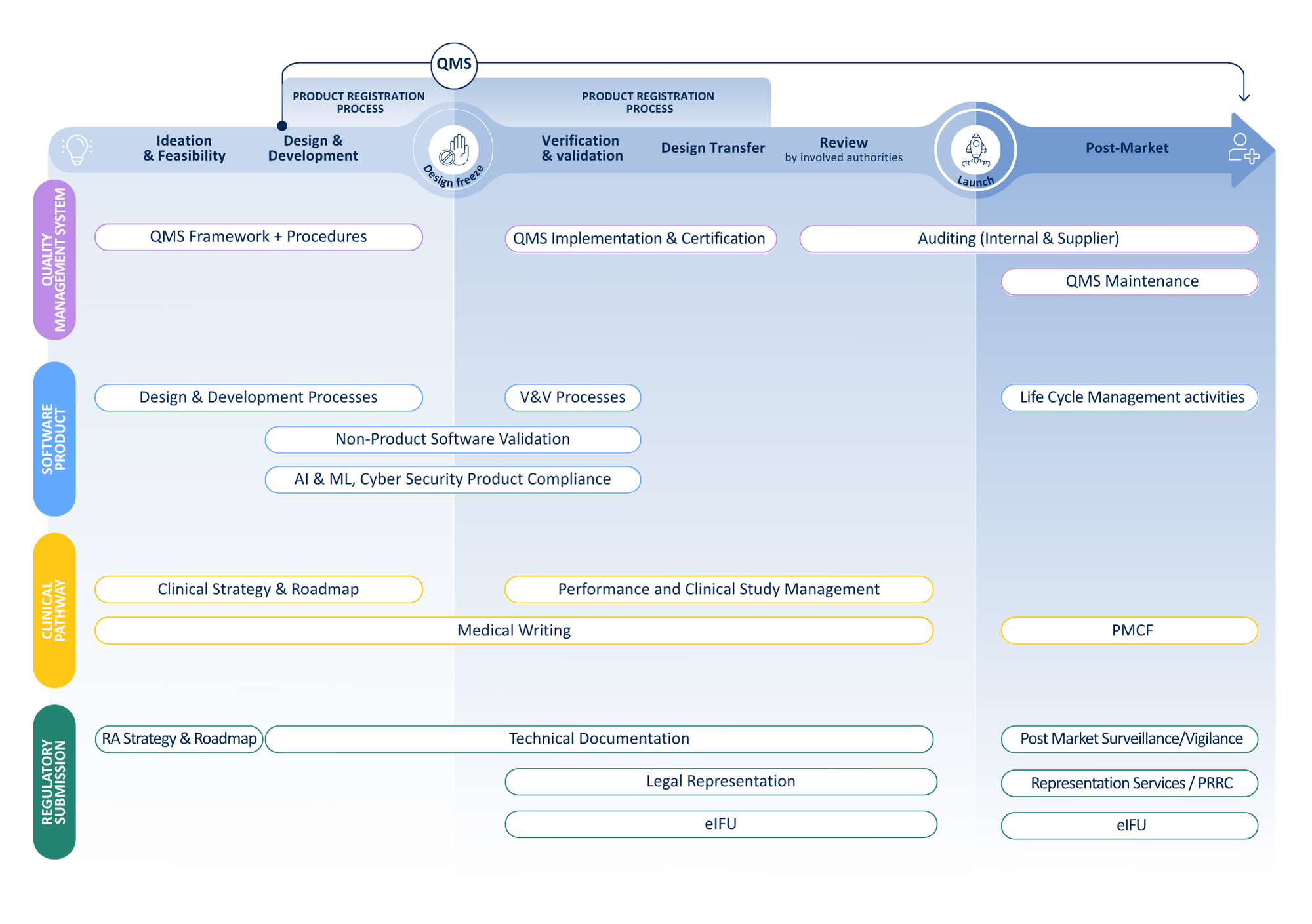
De la idea al paciente
Descubre cómo QbD Group se integra en cada fase del desarrollo de tu dispositivo, desde la idea inicial hasta la supervisión después de su lanzamiento al mercado.
Conoce a nuestros expertos
Llevar a cabo ensayos clínicos para dispositivos médicos requiere una combinación única de conocimiento regulatorio, experiencia clínica y comprensión profunda de los requisitos específicos de cada dispositivo. En QbD Group, nuestro equipo está comprometido con el diseño y la gestión de investigaciones clínicas de alta calidad y rentabilidad, cumpliendo con las exigencias regulatorias y alineándose con los objetivos de tu negocio.
Descubre a los profesionales que te acompañan en cada etapa del ensayo clínico, desde la idea inicial hasta el éxito en la fase clínica.
Kristof Vanschoonbeek
Más de 20 años de experiencia en investigación clínica, incluyendo 3 años en el ámbito médico.
- Doble rol de liderazgo en QbD Clinical
- Experiencia en la gestión de encuestas PMCF
- Liderazgo y desarrollo de equipos
- Amplia trayectoria en investigación clínica y en el ámbito académico
Julie Hendrickx
- Experiencia internacional en la industria farmacéutica y dispositivos médicos.
- Más de 8 años como Clinical Project Manager.
- Gestión integral de proyectos, desde el inicio hasta el cierre del estudio.
Petra De Geest
12 años de experiencia en el campo de dispositivos médicos.
- Evidencia clínica y redacción médica para dispositivos médicos (Clase I a Clase III, incluyendo software médico y software médico impulsado por IA).
- Gestión de seguridad en investigaciones clínicas de dispositivos médicos.
- Liderazgo estratégico y consultoría.
Kristof Vanschoonbeek
- 10 años en Regulación Clínica.
- Presentaciones ante Autoridades Regulatorias y Comités de Ética.
- Conocimiento de MDR y legislaciones nacionales y requisitos (UE).
- Representante legal en la UE.
Casos de clientes: resultados reales en distintos ámbitos terapéuticos
Explora algunos de nuestros estudios y proyectos recientes, que abarcan desde SaMD e insuficiencia cardíaca hasta accidente cerebrovascular y osteoartritis.
Ofrecemos apoyo en todo el mundo y en todas las etapas de los ensayos.

Cardio | Insuficiencia cardiaca
- Gestión de un estudio de seguimiento "First-in-Human" para la tecnología de microordenadores en el corazón contra la cardiopatía isquémica.
- En 12 centros de Europa y Oriente Medio, con 30 sujetos inscritos, nos encargamos de la presentación de solicitudes reglamentarias, la supervisión y la consultoría de MDR.
Ortho | Osteoartritis
- Supervisión de un estudio inicial First-in-Human sobre inyecciones intraarticulares de hidrogel para el tratamiento de la artrosis de rodilla.
- Llevado a cabo en hasta 6 centros de Bélgica, con redacción médica completa, bioestadística y apoyo a la supervisión de la seguridad para 99 sujetos previstos.
Servicios CRO
En QbD Group, nuestro equipo de Clinical Operations (ClinOps) brinda un acompañamiento integral en todas las fases de la investigación clínica, desde el desarrollo temprano hasta el seguimiento postcomercialización. Nos encargamos de todo el proceso del ensayo clínico: gestión del proyecto, selección y cualificación de centros, formación y supervisión de sitios, monitorización basada en riesgos (tanto presencial como en remoto), y coordinación logística.
Además del soporte operativo, nuestros expertos ofrecen servicios en redacción médica y técnica, gestión de calidad y seguridad, asuntos regulatorios clínicos y gestión de datos.
Evaluación de viabilidad
Presentaciones regulatorias
Redacción médica
Gestión de datos
Monitorización de ensayos
Gestión de centros de investigación
Gestión de proyectos
Gestión de seguridad (CEC, DSMB)
Gestión del suministro del estudio
Coordinación con laboratorios centrales
Gestión de calidad
Representante legal

Contacta con nosotros
¿Estás listo para acelerar tu ensayo clínico de dispositivos médicos? Hablemos.

Recursos





.jpg)









.png?width=109&height=108&name=Pharma%20(2).png)


.png?width=720&height=720&name=Kristof%20Vanschoonbeek%20(NO%20BG).png)
.png?width=652&height=652&name=Julie%20Hendrickx%20(1).png)




