
Productos combinados
Navegar por las vías reglamentarias puede parecer a menudo un laberinto, que genera incertidumbre y posibles escollos en el proceso de presentación. Esto es aún más cierto cuando se trata de productos combinados.
No hay nada más descorazonador que invertir mucho tiempo y recursos en el desarrollo de un producto combinado y que las autoridades reguladoras lo rechacen debido a expectativas poco claras o datos insuficientes.
En Qbd Group, ofrecemossoluciones integrales para navegar por el complejo proceso de registro de estos productos innovadores tanto en la Unión Europea (UE) como en los Estados Unidos (EE.UU.).
Productos combinados basados en dispositivos
Si su producto está clasificado como producto sanitario con una sustancia medicinal accesoria, debe cumplir con el EU MDR 2017/745.
- El organismo notificado debe consultar a la EMA para obtener un dictamen científico sobre el excipiente si:
- Se deriva de sangre o plasma humanos.
- Ha sido evaluado previamente por la EMA.
- Entra dentro del procedimiento centralizado.
En otros casos, el Organismo Notificado puede consultar a:
-
La Autoridad Nacional Competente, o
-
La EMA (por ejemplo, si la misma sustancia ha sido evaluada anteriormente).
Combinaciones de medicamentos
Si su producto es principalmente un medicamento, la combinación está regulada por la Directiva de Medicamentos (2001/83/CE).
El tipo de producto -y cómo se integra el producto sanitario- influye en la documentación requerida y los pasos reglamentarios.
Tipos de combinaciones de medicamentos
-
Integrados: El producto sanitario forma parte del producto (por ejemplo, una jeringa precargada).
-
Envasados conjuntamente: El medicamento y el producto están envasados juntos (por ejemplo, inhalador + cartucho).
-
Referenciado: El producto hace referencia a un dispositivo independiente utilizado durante la administración.
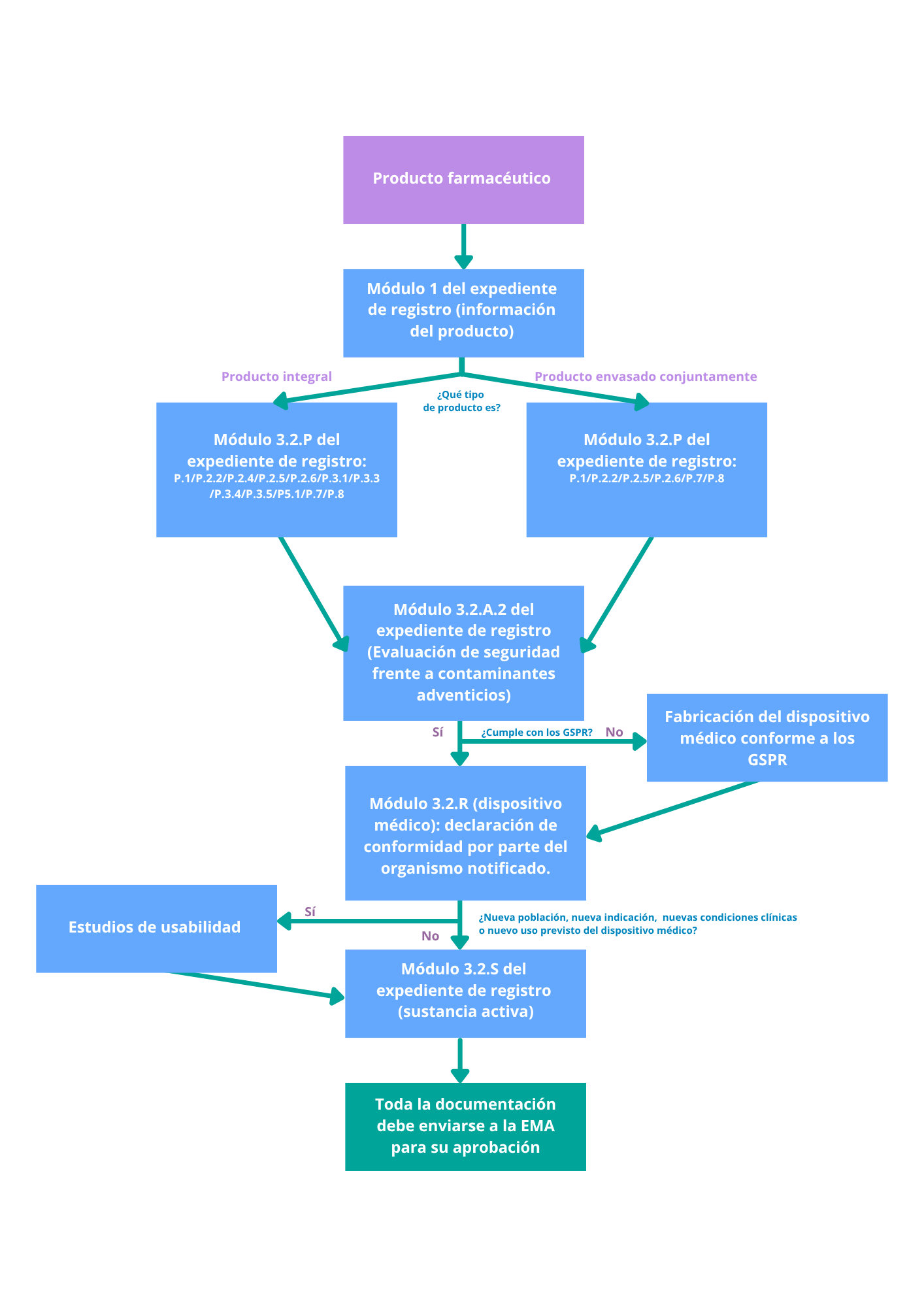
Su hoja de ruta reglamentaria: pasos clave
Utilice el diagrama de flujo que figura a continuación como guía para determinar:
-
De qué autoridad se trata.
-
Qué documentación de calidad se necesita.
-
Cómo preparar su presentación para el cumplimiento.
Ejemplos de productos combinados
|
Ejemplo |
Modo primario | Vía |
|---|---|---|
| Stent liberador de fármacos | Dispositivo | MDR + dictamen de la EMA |
| Jeringa precargada | Fármaco | MPD |
| Parche anticonceptivo | Fármaco | MPD |
| Catéter recubierto | Dispositivo | MDR |
Vía reglamentaria en EE.UU.

Paso 1: identificar el centro principal de la FDA
-
Depende del PMOA (medicamento, dispositivo o producto biológico).
-
Si no está claro, puede presentar una solicitud de designación (RFD ) a la FDA.
-1.jpg?width=540&height=300&name=External%20newsletters%20rechthoek%20(2)-1.jpg)
Paso 2: determinar el tipo de solicitud de investigación
Dependiendo del PMOA, puede aplicarse uno de los siguientes:
-
IND (Investigational New Drug Application) → Se utiliza cuando la modalidad primaria es fármaco o biológico.
-
IDE (Investigational Device Exemption) → Se utiliza cuando la modalidad primaria es dispositivo.
Tenga en cuenta el producto combinado en su conjunto, no sólo sus componentes individuales.

Paso 3: seleccionar la aplicación de marketing adecuada
La aplicación de marketing depende de la parte constituyente con la PMOA:
| PMOA | Solicitud de comercialización |
|---|---|
| Fármaco | NDA (solicitud de nuevo medicamento) o ANDA (NDA abreviada) |
| Biológico | BLA (solicitud de licencia para productos biológicos) |
| Dispositivo | PMA (Aprobación previa a la comercialización), De Novo o Notificación 510(k) |
¿Por qué elegirnos para la gestión del ciclo de vida de los productos combinados?
Orientación experta sobre procedimientos
Gestión integral del ciclo de vida
Profundo conocimiento de la normativa
¿Por qué el Grupo QbD?
En QbD Group, ofrecemos una amplia experiencia para guiar a las empresas de ciencias de la vida a través de complejos entornos normativos y garantizar el cumplimiento durante todo el ciclo de vida del producto.
Nuestro equipo comprende los estrictos requisitos necesarios para desarrollar, aprobar y distribuir productos combinados de forma segura y eficaz.
Más allá de la entrada en el mercado, seguimos apoyando a las empresas mediante la gestión de procesos críticos que garantizan la seguridad, eficacia y conformidad continuas de sus productos antes y después de que lleguen a los pacientes.
+10 años de experiencia
Asistencia durante todo el ciclo de vida
Presencia mundial
Empresa mejor gestionada

Póngase en contacto
¿Tiene preguntas sobre las vías reglamentarias para su producto combinado?
Conocemos la complejidad de las normativas de la UE y EE.UU. Tanto si busca claridad sobre el modo de acción primario (PMOA), como si desea determinar la vía reglamentaria adecuada o gestionar los requisitos del ciclo de vida, nuestros expertos están aquí para ayudarle.
Contenido experto relacionado
.jpg)

Preguntas frecuentes sobre CSV y digitalización para empresas de life sciences













.jpg)








Garantizar una transición fluida de los productos sanitarios de Oystershell al MDR

.jpg)

.jpg)
Últimas noticias del sector



.png)

