Hoy en día, la sanidad digital ocupa un lugar cada vez más importante en el mundo médico a través del software médico, el procesamiento de imágenes, el apoyo al diagnóstico, la monitorización a domicilio, etc... pero todo el software utilizado en un entorno médico no está necesariamente sujeto a la normativa médica. Incluso la definición/designación de software como producto sanitario (SaMD) puede variar de un país a otro.
El Foro Internacional de Reguladores de Dispositivos Médicos (IMDRF) ha publicado orientaciones sobre el software como dispositivo médico (SaMD) y lo que está relacionado con él (más información a continuación), pero es importante tener en cuenta que estas orientaciones no son vinculantes y, por tanto, no todos los países las siguen realmente.
En Europa, por ejemplo, el nombre es diferente: "MDSW" o "Medical Device software". El MDSW cubre un ámbito diferente para el software en el campo médico que el recomendado en las directrices IMDRF. ¿Te has confundido? No te preocupes. Este artículo te ayudará a enumerar las principales diferencias entre SaMD y MDSW para que puedas establecer una estrategia de registro.
SaMD: diferentes significados y niveles de regulación
Diferentes significados: El IMDRF como (mera) directriz
El Foro Internacional de Reguladores de Dispositivos Médicos (IMDRF), creado en febrero de 2011, es un foro formado por reguladores voluntarios de dispositivos médicos de todo el mundo que se han reunido para aprovechar el sólido trabajo fundacional del Grupo de Trabajo de Armonización Global de Dispositivos Médicos (GHTF) y acelerar la armonización y convergencia internacional de las regulaciones de productos sanitarios
Recientemente, la IMDRF ha publicado unas directrices para el "Software as a Medical Device (SaMD)" (disponibles en imdrf.org). Estas directrices no son vinculantes. Los países que aún no disponen de normativa sobre software médico suelen adoptar las recomendaciones de la IMDRF, pero muchos países ya han adoptado su propia normativa.
Como se ha mencionado, la UE ya ha definido el MDSW en el MDR, por ejemplo. En consecuencia, la mayoría de las agencias reguladoras han asignado un significado diferente a SaMD. A menudo, este significado también depende de si el SaMD está integrado en el producto sanitario o no.
Diferentes niveles de regulación en todo el mundo
Además, el nivel de regulación del software en los distintos países también es bastante diferente:
- La UE y Australia regulan un ámbito muy amplio relacionado con el software;
- La mayoría de los países sudamericanos, India, China, Japón y algunos otros tienen un ámbito de aplicación medio;
- Rusia, Canadá y EE.UU. regulan el software en menor medida que todos los países anteriores;
- y el resto del mundo no regula el software en absoluto. (Véase la figura siguiente)
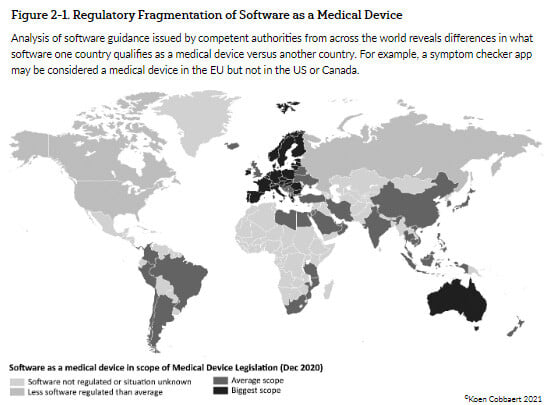
Figura 1 - Software como producto sanitario - Implicaciones reglamentarias y de acceso al mercado por Koen Cobbaert & Gert Bos
SaMD frente a MDSW: definiciones
Cuando se habla de software en entornos médicos, los términos SaMD y MDSW suelen utilizarse indistintamente, pero en realidad no lo son.
Aunque existen algunas similitudes, no cubren el mismo ámbito del software utilizado en el campo médico.
Si sólo hace negocios en Europa, la única definición y normativa relevante de la que debe ocuparse es la de "MDSW" regulada por el MDR, pero si no es su caso, es importante que se fije también en SaMD.
A continuación encontrará ambas definiciones:
¿Qué es SaMD?
El IMDRF define el "software como producto sanitario" o "SaMD" como
"Software destinado a ser utilizado para uno o más fines médicos que realizan los fines sin ser parte de un dispositivo médico de hardware. El software es un SaMD independientemente del hecho de que necesite hardware para ejecutarse. Independientemente de si funciona en equipos informáticos de uso general, en "la nube" o en la plataforma informática de un HW de un Producto sanitario, siempre que no sea "necesario para que el HW del Producto sanitario alcance su finalidad médica prevista."
¿Qué es el MDSW?
El término Software de Producto Sanitario o "MDSW" sólo se utiliza en la UE. (SaMD no se utiliza en la UE). El software de producto sanitario a efectos de clasificación se define en la regla 11 del MDR.
Dicha norma se aplica a los dispositivos que sólo contienen software Y a los dispositivos de hardware que incluyen MDSW como parte integrante.
El MDCG también ha definido el MDSW como tal y ha proporcionado más orientación sobre cómo entender el MDR para el software.
¿En qué se parecen y en qué se diferencian SaMD y MDSW?
Como puede ver, SaMD y MDSW son similares, pero no sinónimos. A continuación, hemos enumerado los puntos en común y las diferencias importantes :
¿Qué tienen en común SaMD y MDSW?
- Tanto SaMD como MDSW cumplen uno o más fines médicos de forma independiente, lo que significa que el software no se utiliza para controlar un dispositivo médico, sino que tiene su propio fin médico.
- Por ejemplo, consideremos la planificación de tratamientos que utiliza imágenes de varios dispositivos de imagen para calcular un tratamiento para un paciente.
- Ambos se aplican al software que funciona en plataformas informáticas de uso general, así como al software que se ejecuta en plataformas que forman parte de un dispositivo médico de hardware.
- Por "plataforma informática de propósito general", entendemos cualquier ordenador utilizado para que ese software se ejecute para analizar unas imágenes de rayos X, por ejemplo, y que no sea el propio ordenador donde se adquieren las imágenes.
- Por "software que se ejecuta en plataformas que forman parte del dispositivo médico", entendemos software adicional instalado en el ordenador, utilizado para adquirir imágenes de rayos X, por ejemplo.
¿Son importantes estos puntos en común? Puede que sí. Si deseas registrar tu software tanto en EE.UU. como en la UE, por ejemplo, puede ser interesante averiguar si tu software cumple ambas normativas (definiciones).
¿Cuáles son las diferencias entre SaMD y MDSW?
- La MDSW también se aplica al software que cumple una finalidad de producto sanitario por sí mismo, pero que al mismo tiempo es necesario para que un producto sanitario alcance su finalidad médica (SaMD). Algunos ejemplos:
- Una calculadora de dosis de insulina que también es necesaria para accionar la bomba de infusión (puede ser un MDSW pero no un SaMD).
- El software integrado en un termómetro es considerado un producto sanitario por el IMDRF y el MDR, pero en EE.UU. esto no es así.
- El MDSW -debido a la definición de producto sanitario del MDR- también incluye cualquier software que "apoye la concepción" y "alivie una discapacidad".
- El MDSW no incluye los programas informáticos cuyo único objetivo sea impulsar o influir en el uso de productos sanitarios. Por ejemplo
- El software para obtener imágenes de rayos X es utilizado únicamente por el hardware de rayos X, como un mamógrafo o un escáner CT.
- El software para obtener imágenes de rayos X es utilizado únicamente por el hardware de rayos X, como un mamógrafo o un escáner CT.
- El SaMD a nivel internacional incluye el software para agregar información con fines médicos, que NO está regulado en la UE. En otras palabras, todo el software que trata información médica en el hospital no se considera producto sanitario en Europa, pero sí en algunos otros países.
Conclusión: comprueba todas las normativas
En conclusión, si deseas lanzar su software al mercado como producto sanitario, es importante que compruebes todas las normativas, ya que existen muchas diferencias.
Nuestros expertos pueden ayudarte a










.jpg)



.jpg)

.jpg)


.jpg)
.png)