
Software para dispositivos médicos
En el mundo actual, los fabricantes de software para dispositivos médicos buscan cubrir las necesidades no satisfechas de pacientes y profesionales sanitarios, aprovechando los últimos avances tecnológicos y el gran incremento de la digitalización.
En QbD Group, abarcamos todo el ciclo de vida del software para dispositivos médicos (MDSW) para apoyarte en todos los retos regulatorios, de calidad, clínicos y de diseño y desarrollo.
¿Qué es el software para dispositivos médicos (MDSW)?
El software desempeña un papel clave dentro y alrededor de los dispositivos médicos. Los dispositivos están “conectados” gracias al surgimiento del Internet de las Cosas (IoT) y sus componentes asociados (smartphones, wearables, servidores en la nube, sensores más baratos y precisos). Además, el big data y la inteligencia artificial potencian aún más las capacidades del software para dispositivos médicos. Al mismo tiempo, los retos de la ciberseguridad imponen exigencias adicionales a estas empresas innovadoras.
Las compañías de dispositivos médicos deben centrar su atención en una amplia variedad de tareas. No solo los aspectos técnicos e innovadores de su producto requieren cuidado, sino que los aspectos regulatorios, de calidad y técnicos son complejos y, a veces, subestimados.
Según la normativa europea de dispositivos médicos, es decir, el Reglamento 2017/745 (MDR) y el Reglamento 2017/746 (IVDR), la clasificación de riesgo del software para dispositivos médicos (MDSW) es relativamente compleja y, en la mayoría de los casos, conlleva una clase de riesgo más alta en comparación con las antiguas directivas de dispositivos médicos. Esto, junto con el constante cambio del estado de la técnica, conlleva un aumento de los requisitos regulatorios, de calidad y técnicos.
Se espera que los fabricantes de software para dispositivos médicos cumplan con las normas y directrices aplicables a MDSW (por ejemplo, ISO 13485, ISO 14971, IEC 62304, IEC 82304, IEC 62366, etc.), así como con diversas regulaciones como el AI Act y el RGPD, manteniendo siempre la ciberseguridad como prioridad (ISO 81001, etc.).
¿Qué es el software para dispositivos médicos (MDSW)?
El software desempeña un papel clave dentro y alrededor de los dispositivos médicos. Los dispositivos están “conectados” gracias al surgimiento del Internet de las Cosas (IoT) y sus componentes asociados (smartphones, wearables, servidores en la nube, sensores más baratos y precisos). Además, el big data y la inteligencia artificial potencian aún más las capacidades del software para dispositivos médicos. Al mismo tiempo, los retos de la ciberseguridad imponen exigencias adicionales a estas empresas innovadoras.
Las compañías de dispositivos médicos deben centrar su atención en una amplia variedad de tareas. No solo los aspectos técnicos e innovadores de su producto requieren cuidado, sino que los aspectos regulatorios, de calidad y técnicos son complejos y, a veces, subestimados.
Según la normativa europea de dispositivos médicos, es decir, el Reglamento 2017/745 (MDR) y el Reglamento 2017/746 (IVDR), la clasificación de riesgo del software para dispositivos médicos (MDSW) es relativamente compleja y, en la mayoría de los casos, conlleva una clase de riesgo más alta en comparación con las antiguas directivas de dispositivos médicos. Esto, junto con el constante cambio del estado de la técnica, conlleva un aumento de los requisitos regulatorios, de calidad y técnicos.
Se espera que los fabricantes de software para dispositivos médicos cumplan con las normas y directrices aplicables a MDSW (por ejemplo, ISO 13485, ISO 14971, IEC 62304, IEC 82304, IEC 62366, etc.), así como con diversas regulaciones como el AI Act y el RGPD, manteniendo siempre la ciberseguridad como prioridad (ISO 81001, etc.).
MDSW: desarrollo, conformidad y comercialización
Estrategias globales de acceso al mercado
La introducción en el mercado de software para dispositivos médicos es un proceso polifacético que requiere una cuidadosa navegación por un panorama en rápida evolución. El software desempeña un papel fundamental en la atención sanitaria, ya que mejora los diagnósticos, los tratamientos personalizados y el seguimiento de los pacientes.
Para comercializarlo con éxito, las empresas deben comprenderla dinámica del mercado, incluidas las necesidades de los proveedores sanitarios, los pagadores y los pacientes, al tiempo que seajustan a los requisitos normativos. Para ello, es esencial implicar a los principales líderes de opinión, demostrar su valor a través de datos clínicos y garantizar que el software encaja en los sistemas nacionales de reembolso sanitario.
Además, unaestrategia de comunicación eficaz que destaque las ventajas del producto y el mensaje de la marca puede mejorar significativamente la entrada en el mercado.
En última instancia, el éxito radica en laevaluación y adaptación continuas, que garanticen que el software satisface las cambiantes demandas clínicas y normativas.
¿Necesita ayuda para introducir con éxito en el mercado su software para dispositivos médicos? Póngase en contacto con nosotros hoy mismo. Nuestro equipo de expertos está preparado para guiarle a través del proceso de comercialización.
Vea nuestro seminario web a la carta para obtener más información sobre las estrategias clave para la entrada en el mercado y el cumplimiento normativo.
Desarrollo de software para dispositivos médicos
El desarrollo de software para dispositivos médicos es un proceso complejo que exige un estricto cumplimiento de las normas internacionales y los requisitos reglamentarios.
Normas clave comoIEC 62304, IEC 62366 e ISO 14971 rigen el ciclo de vida del desarrollo de software, la usabilidad y la gestión de riesgos, garantizando la seguridad y el cumplimiento durante todo el proceso. Los desarrolladores deben elegir entre metodologías comoWaterfall o Agile, equilibrando la necesidad de flexibilidad con las rigurosas exigencias de la normativa sobre productos sanitarios.
Además, es esencial comprenderlas clasificaciones de seguridad del software, ya que el nivel requerido de documentación y pruebas varía en función del riesgo asociado al software. A medida que surgen nuevas normativas como laLey de IA, junto con las crecientes demandas de ciberseguridad, las empresas deben garantizar que susprocesos de desarrollo sean sólidos, seguros y preparados para el futuro.
Navegar con éxito por estas complejidades permite a las organizaciones ofrecer un software seguro y eficaz que cumpla tanto las normas clínicas como las reglamentarias.
¿Desea optimizar su proceso de desarrollo de software para dispositivos médicos? Póngase en contacto con nosotros para obtener asesoramiento experto sobre cómo alinear sus prácticas de desarrollo con las normas del sector y los requisitos normativos.
No olvide consultar nuestro seminario web a la carta para conocer en profundidad las mejores prácticas en el desarrollo de software para dispositivos médicos.
Integración de las necesidades clínicas en el diseño y la documentación del MDSW
La incorporación de las necesidades clínicas en el diseño del software de dispositivos médicos es esencial para garantizar el cumplimiento de la normativa y la eficacia clínica del software.
Este proceso comienza con una sólida evaluación clínica, como exige el Reglamento de Productos Sanitarios (MDR), que exige a los fabricantes reunir pruebas clínicas suficientes para demostrar la seguridad y el rendimiento del software. La evaluación clínica incluye etapas como larevisión sistemática de la bibliografía, que evalúa el estado actual de la atención sanitaria y ayuda a identificar posibles riesgos y lagunas. Definir lafinalidad prevista del dispositivo -incluidossu uso médico, la población de pacientes destinataria y los beneficios clínicos esperados- es fundamental para dar forma al diseño.
Además, unaevaluación exhaustiva de la relación beneficio-riesgo equilibra los resultados clínicos positivos del software con los riesgos asociados.El seguimiento clínico postcomercialización ( PMCF) garantiza la seguridad y el rendimiento continuos del dispositivo mediante la recopilación continua de datos y pruebas en el mundo real.
Al integrar estos elementos clínicos tanto en el diseño como en la documentación, las empresas pueden producir software que cumpla las exigencias normativas y aporte un valor significativo tanto a los profesionales sanitarios como a los pacientes.
Asegúrese de que su software se diseña teniendo en cuenta las necesidades clínicas. Póngase en contacto con nosotros para que le ayudemos a adaptar el diseño de su software a los requisitos clínicos.
Si desea más información, vea nuestro seminario web a la carta sobre la integración de estrategias clínicas en el desarrollo de software para dispositivos médicos.
Documentación técnica esencial para MDSW
La creación de una sólida documentación técnica (TD) es vital para el cumplimiento de la normativa y el éxito en el mercado del software de dispositivos médicos. La TD describe la información crítica, desde lacualificación y clasificacióndel software hasta las medidas deciberseguridad y las pruebasdel producto.
La clasificación sigue directrices como elMDCG2019-11, que cubre el software independiente, el software como accesorio y el software que afecta a la función del dispositivo. La evaluación de la conformidad requiereuna verificación exhaustiva, validación y documentación de ciberseguridad, mientras que las normas emergentes de IA exigen transparencia y estrategias de gestión de riesgos.
Elementos adicionales como el sistemade Identificación Única de Dispositivos ( UDI) para el seguimiento de las actualizaciones de software y unorganismo notificado bien elegido son esenciales para cumplir las exigencias normativas. Una vez certificadas, las empresas deben mantener actualizada la documentación y llevar a cabo una vigilancia posterior a la comercialización para garantizar la seguridad y el cumplimiento continuos.
Para obtener más información sobre cómo podemos ayudarle con sus necesidades de documentación técnica para software de productos sanitarios, póngase en contacto con nosotros hoy mismo. Nuestro equipo está aquí para guiarle en todos los aspectos de la conformidad.
También puede ver nuestro seminario web a petición para obtener información detallada y consejos prácticos sobre la creación y el mantenimiento de una documentación técnica eficaz.

Es innegable que el futuro de la tecnología médica y todas las posibles aplicaciones del software para dispositivos médicos (MDSW) resultan apasionantes. Sin embargo, la normativa impone requisitos específicos a lo largo de todo el ciclo de vida del dispositivo. Estamos aquí para ayudarte
Cómo podemos ayudarte

MDSW Diseño y Desarrollo
- EC 62304:2006 - Software de productos sanitarios - Procesos del ciclo de vida del software
- Principios de diseño y desarrollo de MD
- Gestión de riesgos ISO14971:2019
- Validación de software - CSV
- IEC 82304-1:2016 - Software sanitario
- Soporte postcomercialización
- Soporte QA
Acelere su viaje con nuestros seminarios web MDSW
.jpg?width=1600&height=900&name=IT%20Infrastructure%20Qualification%20-%20Software%20Solutions%20and%20Services%20-%20QbD%20Group%20(2).jpg)
Superar los obstáculos iniciales en el desarrollo de MDSW
.jpg?width=1280&height=720&name=Software%20implementations%20(1).jpg)
De los requisitos al código: el ciclo de desarrollo de MDSW

Integración de las necesidades clínicas en el diseño y la documentación
Últimas noticias del sector

Recursos
-1.jpg)
.jpg)

Preguntas frecuentes sobre CSV y digitalización para empresas de life sciences













.jpg)








Garantizar una transición fluida de los productos sanitarios de Oystershell al MDR

.jpg)

.jpg)
Conéctese con nosotros en estos eventos
marzo
abril
mayo
junio
septiembre




%20and%20Post-Market%20Clinical%20Follow-Up%20(PMCF)%20under%20the%20MDR%20ensuring%20safety%20and%20performance.jpg?width=1600&height=900&name=Post-Market%20Surveillance%20(PMS)%20and%20Post-Market%20Clinical%20Follow-Up%20(PMCF)%20under%20the%20MDR%20ensuring%20safety%20and%20performance.jpg)
.jpg?width=1200&height=900&name=Pharmacovigilance%20QMS%20and%20PSMF%20Services%20%20Vigilance%20-%20QbD%20Group%20(2).jpg)
-1.jpg?width=540&height=300&name=External%20newsletters%20rechthoek%20(2)-1.jpg)
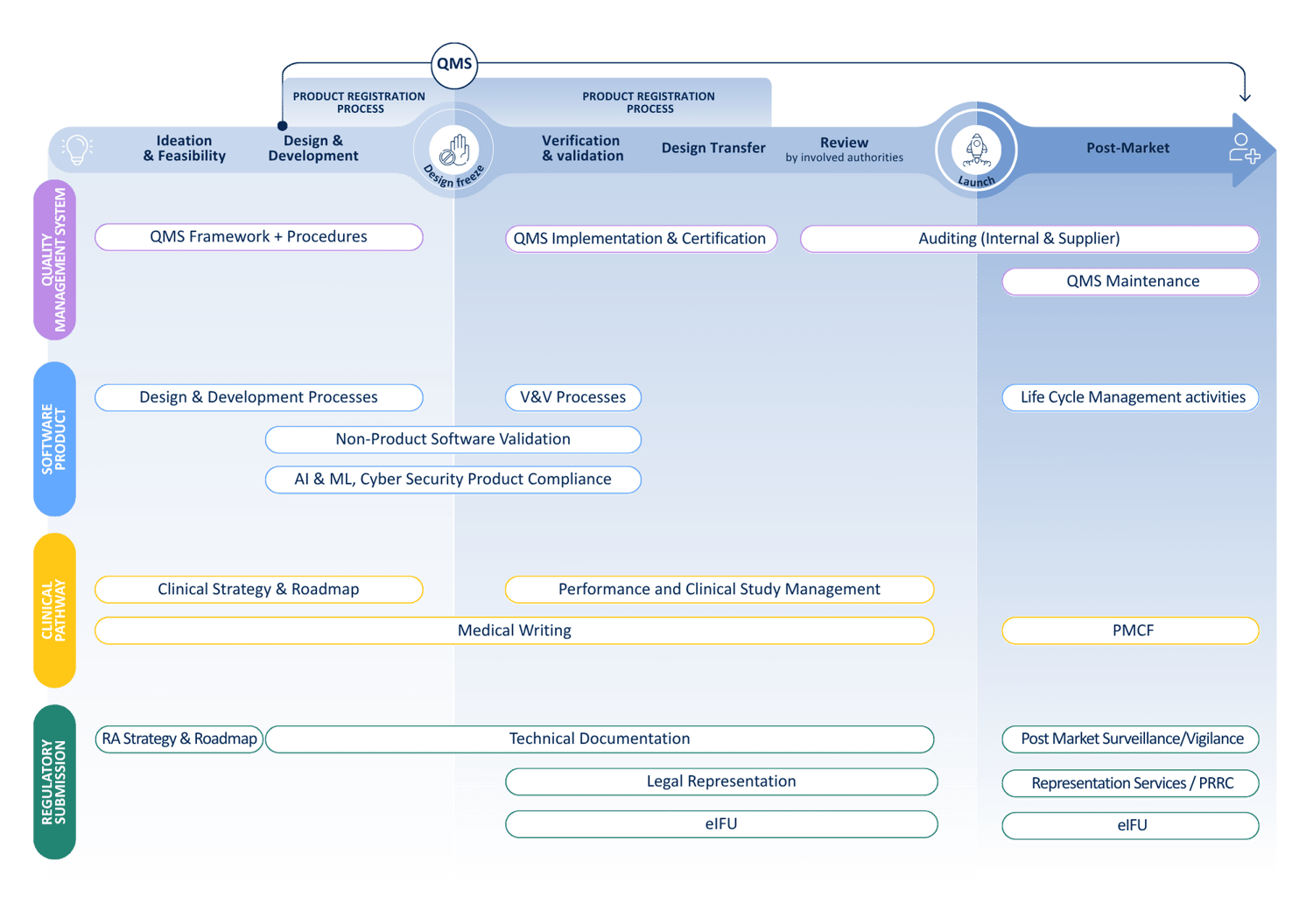

.png)