
Servicios de representante autorizado
Tu socio estratégico en regulación para Dispositivos Médicos e IVDs
Los fabricantes de dispositivos médicos y dispositivos de diagnóstico in vitro (IVDs) ubicados fuera de las principales regiones regulatorias están legalmente obligados a designar un Representante Autorizado (AR) para poder comercializar sus productos en esos mercados.
Ya sea que estés accediendo a Europa (UE), al Reino Unido o a Suiza, QbD Group te ofrece una representación experimentada, independiente y plenamente conforme para ayudarte a cumplir con todos los requisitos regulatorios.
¿Qué es un representante autorizado?
Un Representante Autorizado es una entidad legal establecida dentro de una jurisdicción específica que actúa en nombre de un fabricante ubicado fuera de la UE, del Reino Unido o de Suiza.
Este representante sirve como principal punto de contacto entre el fabricante y las autoridades competentes locales, asegurando el cumplimiento de la normativa de productos sanitarios y dispositivos de diagnóstico in vitro de la región, y gestionando las responsabilidades post-comercialización.
Qué ofrecemos
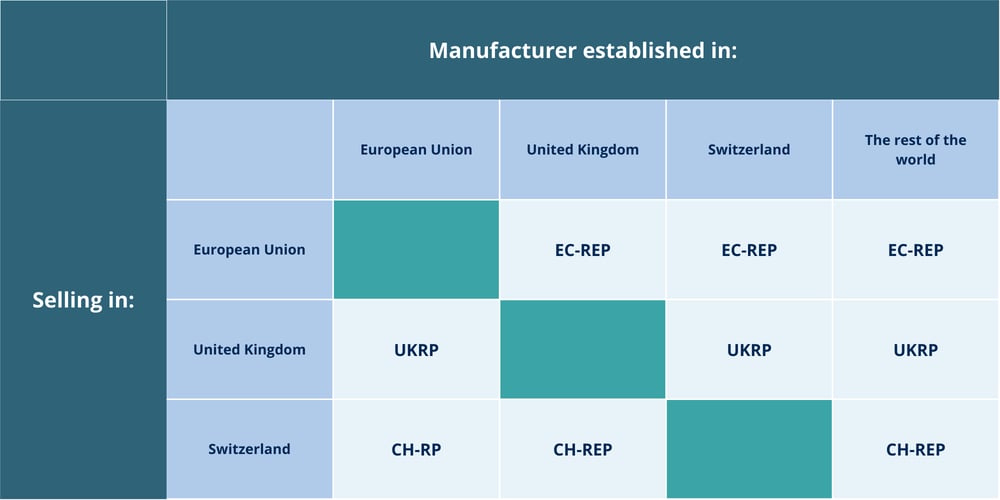
Nuestros expertos en regulación actúan como EU-REP, UKRP y CH-REP para facilitar el acceso de tus dispositivos médicos (MD) y de diagnóstico in vitro (IVD) a los mercados europeo, británico y suizo.
Verificación de la documentación
Asegurarse de que se han redactado la declaración de conformidad y los documentos técnicos.
Confirmación de conformidad
Comprobar que el fabricante ha cumplido las obligaciones de registro.
Etiquetado e identificación
Gestión de incidentes y reclamaciones
Comunicación con las autoridades
Soporte en la Vigilancia del mercado
.jpg?width=1600&height=900&name=Legal%20Representative%20-%20Regulatory%20Affairs%20-%20QbD%20Group%20(4).jpg)
Asóciate con confianza: por qué elegir a QbD Group como tu Representante Autorizado
- Experiencia multimercado
Garantizamos el pleno cumplimiento de las normativas MDR/IVDR de la UE, así como de las regulaciones del Reino Unido y Suiza, brindándote una representación fiable en los tres mercados clave. - Mucho más que representación
Más allá de cumplir con los requisitos legales, te ofrecemos un soporte integral que incluye estrategia regulatoria, documentación técnica y vigilancia post-comercialización. - Experiencia regulatoria sin fronteras
Gracias a una amplia red de consultores regulatorios en la UE, Reino Unido y Suiza, QbD Group combina conocimiento local con coherencia regulatoria a nivel internacional. - Comunicación directa con expertos
Trabajarás directamente con profesionales con experiencia en regulación: respuestas rápidas, trato transparente y atención personalizada. - Socio de acceso de confianza
Como tu EU-REP, UKRP y CH-REP, actuamos como punto de contacto oficial ante las autoridades y proporcionamos la documentación requerida cuando se solicite. - Servicios para todas las clases de productos
Ofrecemos servicios consistentes y fiables de Representante Autorizado para todas las clases de dispositivos y categorías de IVD, garantizando el cumplimiento normativo sin importar el perfil de riesgo de tu producto.
Servicios de representante autorizado de confianza para la UE, el Reino Unido y Suiza
Con más de 300 clientes en todo el mundo, somos un proveedor líder de servicios de Representante Autorizado (AR), ayudando a los fabricantes a cumplir con los requisitos regulatorios en la UE, el Reino Unido y Suiza.
Selecciona el servicio que mejor se adapte a tus necesidades para saber más:
Más que representación: tu aliado integral en cumplimiento
Nuestro servicio de Representante Autorizado forma parte de un marco regulatorio y de calidad completamente integrado, diseñado para garantizar el cumplimiento de tu dispositivo en cada etapa.
En QbD Group vamos más allá de la representación autorizada tradicional. Nos convertimos en tu socio regulatorio a largo plazo, acompañando tu acceso al mercado y asegurando un cumplimiento continuo durante todo el ciclo de vida del dispositivo.
Asesoría en Regulatory Affairs
Servicios de Calidad y Auditoría
Vigilancia y Seguimiento Poscomercialización
Formación y Revisiones de Cumplimiento
¿Por qué elegir QbD Group?
Visión global, experiencia local
Con centros reguladores en toda Europa y experiencia internacional, ofrecemos soluciones inteligentes y escalables para los fabricantes de tecnología médica.
Excelencia reguladora
Respaldados por líderes del sector como Qarad, aportamos más de 20 años de experiencia en el cumplimiento normativo de dispositivos médicos e IVD.
Asistencia integral
Desde el marcado CE hasta las obligaciones posteriores a la comercialización, QbD Group te ayuda a gestionar el ciclo de vida completo de tu producto en los mercados clave.
Enfoque personalizado y proactivo
Nuestro equipo colabora estrechamente con el tuyo para alinear tu estrategia regulatoria con tus objetivos empresariales.
.jpg?width=1080&height=1350&name=In-country%20representative%20service%20-%20Regulatory%20Affairs%20-%20QbD%20Group%20(1).jpg)
Contenidos relacionados








.jpg)




.jpg)

.jpg)

Garantizar una transición fluida de los productos sanitarios de Oystershell al MDR

.jpg)

Ponte en contacto
Ponte en contacto con nosotros para obtener más información o solicitar una propuesta gratuita y sin compromiso.





.png)